ORIGEN.
La química en general aportando viene muchas cualidades, como parte de investigación, de los recursos, fenómenos atmosférico de nuestro universo paralelo, ya que mas nos ayuda descubrir los estados de la materia y de sabre mas sobre los recursos naturales, químicos, radioactivos, y poder manipularlos de forma segura, y causar el pecado algún tipo de accidente.
OBJETIVOS DE LA QUÍMICA.
En la Base de ya viene Interpretar, sus conceptos que son de gran importancia en la parte industrial.
Diferencia los estados y propiedades de la materia.
Interpretación las generalidades de los cuerpos de las leyes de como que rigen la materia.
Comprende los fenómenos que se producen y que de cierta forma modifican las propiedades de permanente de la materia.
Explica las relaciones que se encuentran entre materia y energía.
martes, 19 de mayo de 2015
lunes, 18 de mayo de 2015
Operación y relación
OPERACIONES FUNDAMENTALES.
En la química como bases de operaciones de experimentos para poder descomponer los materiales conocidos para hallar sus componentes mas sencillos y sus operaciones vienen a ser.
ANÁLISIS
En la química como bases de operaciones de experimentos para poder descomponer los materiales conocidos para hallar sus componentes mas sencillos y sus operaciones vienen a ser.
ANÁLISIS
- Suele ser la simplificación, descomposición o desintegración de los materiales que son comúnmente conocidos para investigar los componentes mas sencillos de una muestra química.
SÍNTESIS
- Esta operación es totalmente contraria al análisis. La síntesis consiste en forma una sustancia partiendo de los elementos que lo componen.
RELACIONES QUÍMICAS CON OTRAS CIENCIAS
En si la química como otras ramas de la ciencia es la que tiene mayor relación para ejecutar una buena investigación como los cuales son;
- biologia
- astronomia
- física
- medicina
- ingeniería
- matematicas
domingo, 17 de mayo de 2015
Beneficios y riesgos
BENEFICIOS
Con la química y otras ciencias mas podemos obtener mayores beneficios como son;
- Muy importante para nuestra salud (medicamentos) y para una mejor calidad de vida.
- La química se utiliza para la elaboración de material de construcción.
- Nos permite una buena conservación de los alimentos.
- También tiene un buen fin estético en su razón como un mejor beneficio para las mujeres como son los labiales y esmaltes.
SUS RIESGOS
Bueno en mi lo personal como todo bueno en la vida siempre viene a tener algo malo, como en la química en sus beneficios también vienen sus riesgos, como lo cual hay materiales con mala manipulación vendría a ver almacenamientos de material nocivo o perjudicial, que en su fabricación, puede ser mortal o radioactivo para un ser humano o ser vivo.
En tiempos antiguos se a venido elaborando la pólvora como la elaboración de autos que vienen a soltar sustancias nocivas que vienen poniendo en peligro a nuestro planeta,
las infecciones por radiactividad viene a ser mucho mas peligroso ya que no sabríamos que efectos traerian en un ser vivo
las infecciones por radiactividad viene a ser mucho mas peligroso ya que no sabríamos que efectos traerian en un ser vivo
sábado, 16 de mayo de 2015
Método Cientifico y partes de la quimica
MÉTODO CIENTÍFICO
En toda ciencia siempre hay un método científico y en la química vendría a ser:
- Planteamiento del problema.- Vendría a ser la primera etapa que se llamaría Observación que es reconocer el problema.
- Formulación de hipótesis.- En la segunda etapa obtendría suposiciones verosímiles y contrastables para explicar el problema.
- Diseño de experimentos para comprobación de la hipótesis.- En su experimentos diseña para confirmar o descartar las hipótesis buscando relaciones entre ellas, controlando variables no medidas que puedan influir.
QUÍMICA
- Química general.- estudia los principios básicos de la constitución las propiedades y transformaciones de las sustancias, a demás de estudiar las leyes generales de la química.
- Química inorgánica.- Estudia los diversos elementos y compuestos que con ellos se forman inorgánicos, a excepción del carbono y sus compuestos.
- Química orgánica.- Estudia los compuestos que contienen carbono, ya sean producidos por los seres vivos o sinterizados en un laboratorio por el ser humano.
- Química analítica.- investiga la composición de las sustancias esta para viene el análisis cualitativo que identifica los componentes desconocidos existentes en sus sustancia y análisis cuantitativo que indica las cantidades relativas de los componen existente en una sustancia.
- Química física.- Estudia las áreas importantes como la termodinámica la ciencia química y el estado solido de las sustancias.
- Química ambiental.- Estudia la base química para entender la composición del ambiente natural y los procesos que se llevan a cabo en el medio ambiente, así como los cambios que se producen en el medio ambiente como resultado de las actividades humanas.
viernes, 15 de mayo de 2015
Materia, energia y cuerpo
MATERIA
La materia en la química es todo lo que posee masa y ocupa un lugar en el espacio.
y en ciertas partes los cambios que la materia sufre involucra ganancia o perdida de energía.
Se clasifica en:
Mezclas.- Se diferencia en dos tipos:
- Heterogéneas
- Homogéneas
Sustancias Puras.- Estos procesos pueden ser:
- Compuestos
- Sustancias simples
Entre las dos clasificaciones los resultados se diferencia con metales y no metales y sus símbolos que los representan.
ENERGÍA
La energía para hacer un trabajo.
CUERPO
Ea la porción limitada de materia con forma determinada.

jueves, 14 de mayo de 2015
Clasificacion de la materia
CLASIFICACIÓN DE LA MATERIA: SUSTANCIAS PURAS
Las fases se presentan una composición fija, y puede separarse por medios físicos y su temperatura pertenece constante durante el cambio de estado.
se clasifican en sustancias pura simple y sustancias compuestas, se varían en elementos, son sustancias simples que no se descomponen por medios químicos como el oro que tiene un gran clasificación de aquellas sustancias que no necesita ninguna combinación o mezcla ya que seria una sustancia pura.
y aquellos compuestos son sustancias que están formadas por dos o mas elementos y pueden descomponerse por medios químicos como las sal que necesita dos elementos químicos para formarse.

MEZCLAS
Una mezcla esta formado por dos o mas sustancias, por ejemplo el H2O que son dos sustancias por lo tanto se caracteriza por tener composición variable, pueden separarse por medios físicos y su temperatura es variable durante el cambio físico y su temperatura es variable. y sus mezcla ya varían como sus mezclas que son:
Mezclas Homogéneas.- Están formadas por dos o mas componentes y presentan una sola fase.
Mezcla Heterogéneas.- Están formados por dos o mas componentes y presentan dos o mas fases.
miércoles, 13 de mayo de 2015
Propiedades fisicas de la materia
PROPIEDADES FÍSICAS
Son aquellas que se pueden determinar sin alterar la identidad de la sustancia. pueden ser generales o particulares y sus generalidades que son:
- Inercia
- Elasticidad
- Impenetrabilidad
- Discontinuidad
- Indestructibilidad
- Divisibilidad
Propiedades físicas particulares que identifican las sustancias son:
- Densidad
- Dureza
- Maleabilidad
- Ductilidad
- Viscosidad

INERCIA.- Es la propiedad por la que todos los cuerpos tienden a mantenerse en su estado de reposo o movimiento.

IMPENETRABILIDAD.- Es la imposibilidad que dos cuerpos distintos ocupen el mismo espacio simultáneamente, en la resistencia que pone un cuerpo a ser traspasado.

DISCONTINUIDAD.- Se refiere a que la materia esta formada por partículas, antes se pensaba que la materia era continua que podría dividirse infinitamente y cada despacito conservaba sus propiedades.

ELASTICIDAD.- Propiedad que tienen los cuerpos de cambiar su forma cuando se les aplica su fuerza adecuada y de recobrar la forma original cuando se suspende la acción de la fuerza.

INDESTRUCTIBILIDAD.- Propiedad que tiene los cuerpos de ser indestructibles ley de lavoisier.

DENSIDAD.- Cantidad de masa ejercida por un volumen dado a un material, usualmente expresada en libras por pie o gramos por centímetro, en el caso de los gases, la densidad es afectado de manera importada por la temperatura y la presión.
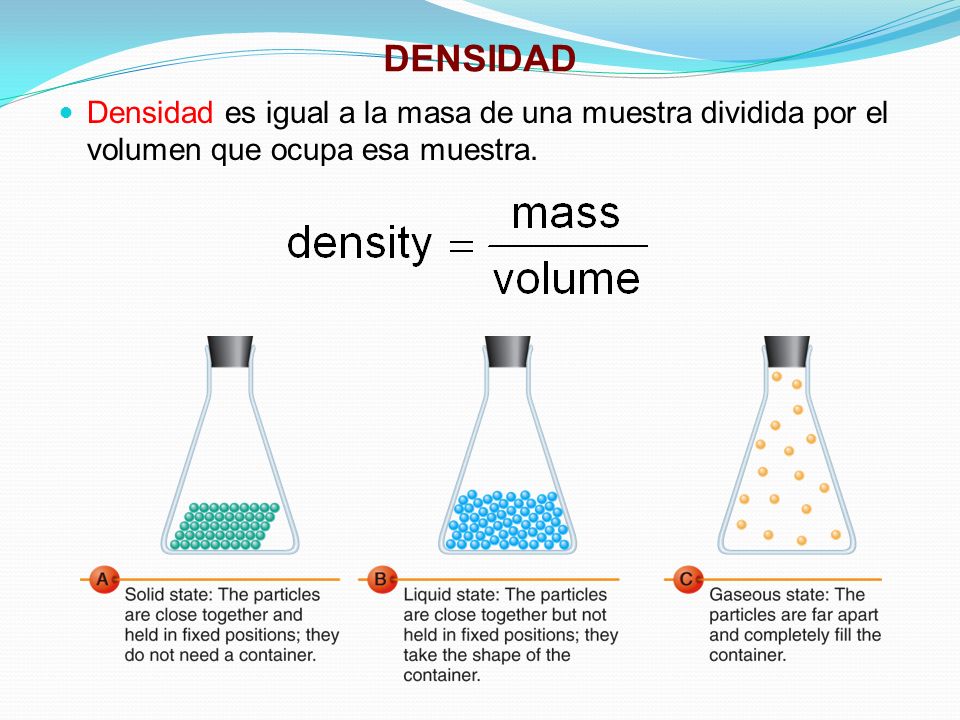
DUREZA.- Propiedades de los sólidos, es la resistencia de la deformación, es mineralogíase utiliza la escala mohs creada por el austriaco Friedrich Mohs, que mide la resistencia al rallado de los materiales.
DIVISIBILIDAD.- Es la propiedad que tiene cualquier cuerpo para poder dividirse en pedazos mas pequeños, hasta llegar a las moléculas y átomos.

martes, 12 de mayo de 2015
Cambios de la materia, energia
LOS CAMBIOS DE ESTADO
CONDENSACIÓN.- Es el paso de forma gaseosa a forma liquida. Es el proceso inverso a la vaporacion.
SUBLIMACIÓN.- Es el cambio de estado de materia solida al estado gaseoso sin pasar por el estado liquido.
FUSIÓN.- Es el paso de un solido al estado liquido por medio del calor que el cual seria un proceso endotermico.
SOLIDIFICACIÓN.- Es el paso de liquido a solido por medio del enfriamiento que es un proceso exotermico.
VAPORIZACIÓN.- Es el cambio de estado liquido a gaseoso y hay dos tipos de vaporización, la ebullición y la evaporación.
ENERGÍA
la energía es una propiedad asociada a los objetos y sustancias y se manifiesta en las transformaciones que ocurren en la naturaleza y la energía se manifiesta en los cambios físicos, por ejemplo, al elevar un objeto, transportarlo, de formarlo o calendario. La energía se diferencia en:
- La energía química que es la que se produce en las reacciones químicas que el cual puede ser retenida en alimentos, elementos o combustibles.
- la energía electrónica es causada por el movimiento de las cargas eléctricas en el interior de los materiales conductores, es una de las formas de energía mas empleadas
- la energía luminosa que se transporta por la luz y siempre es producida por las ondas que la luz obtiene o previene de cualquier fuente de luz como el sol, una bombilla, el fuego y otros.
- la energía solar es la que llega a la tierra en forma de radiación electromagnética.
- la energía magnética se refiere a la posición y movimiento de un cuerpo y la suma de las energías de un cuerpo en movimiento.
- la energía magnética es aquella que se extrae del aprovechamiento de las energías cinética y potencial de la corriente de los ríos, saltos de agua y mareas.
- La energía nuclear es la liderada del resultado de una reacción nuclear, se puede obtener por fusión nuclear y la unión de sus átomos fusionan la división de núcleos atómicos.
- la energía electromagnética se define como la cantidad de energía almacenada en una parte del espacio que se expresa se según la fuerza de un campo eléctrico y magnética.
- la energía eólica se obtiene a través del viento ya que gracias a su ayuda cinética generada por el efecto corriente de aire es utilizada para producir eléctrica o energía eléctrica.
Estados de la materia
ESTADOS DE LA MATERIA
Los estados de la materia vendría a ser:
ESTADO SOLIDO.- Las fuerzas de cohesión de sus moléculas son mayores que las fuerzas de repulsión, sus cuerpos son compactos, presentan volumen y forma definida.



Los estados de la materia vendría a ser:
ESTADO SOLIDO.- Las fuerzas de cohesión de sus moléculas son mayores que las fuerzas de repulsión, sus cuerpos son compactos, presentan volumen y forma definida.

ESTADO LIQUIDO.- Las fuerzas de cohesión son similares a las fuerzas de dispersión, presentan un volumen definido, su forma es variable de acuerdo al recipiente que lo contienen.

ESTADO GASEOSO.- Las fuerzas de dispersión o expansión son mayores que la fuerzas de atracción en las moléculas de los gases, por lo tanto no tienen volumen ni forma definida.

lunes, 11 de mayo de 2015
LEY DE LA CONSERVACIÓN DE LA ENERGIA
LEY DE LA CONSERVACIÓN DE LA ENERGIA
La ley de conservación de la energía, también conocida como primer principio de la termodinámica establece que “aunque la energía se puede convertir de una forma a otra no se puede crear ni destruir”. La energía es la capacidad de los cuerpos o sistemas de cuerpos para efectuar un trabajo.
La masa: p.v
El volumen: m/p
FORMULA PARA CALCULAR LA ENERGÍA POTENCIAL:
Ep = m. g.h
Ec = ½.m.v2
Em = Ep + Ec


La ley de conservación de la energía, también conocida como primer principio de la termodinámica establece que “aunque la energía se puede convertir de una forma a otra no se puede crear ni destruir”. La energía es la capacidad de los cuerpos o sistemas de cuerpos para efectuar un trabajo.
Sistema internacional de unidades
Fórmulas:
La densidad: P: m/vLa masa: p.v
El volumen: m/p
ENERGÍA POTENCIAL:
La gravedad es una constante de 9,8 m/s2FORMULA PARA CALCULAR LA ENERGÍA POTENCIAL:
Ep = m. g.h
ENERGÍA CINÉTICA
FORMULA PARA CALCULAR LA ENERGÍA CINÉTICA:Ec = ½.m.v2
ENERGÍA MECÁNICA:
FORMULA PARA CALCULAR LA ENERGÍA MECÁNICA:Em = Ep + Ec
TEMPERATURA:
°C (Celsius)
°C=5(°F-32)/9
°F (Farhenheit)
°F=9x°C/5+32
K (Kelvin)
L=°C+273
°R (Rankine)
°R=°F+459.67


domingo, 10 de mayo de 2015
Atomos y numeros cuanticos
ÁTOMOS
Los átomos son objetos muy pequeños con masas igualmente minúsculas: su diámetro y masa son del orden de la billonésima parte de un metro y cuatrillonésima parte de un gramo. Solo pueden ser observados mediante instrumentos especiales tales como un microscopio de efecto túnel. Más de un 99,94 % de la masa del átomo está concentrada en su núcleo, en general repartida de manera aproximadamente equitativa entre protones y neutrones. El núcleo de un átomo puede ser inestable y sufrir una transmutación mediante desintegración radioactiva. Los electrones en la nube del átomo están repartidos en distintos niveles de energía u orbitales, y determinan las propiedades químicas del mismo. Las transiciones entre los distintos niveles dan lugar a la emisión o absorción de radiación electromagnética en forma de fotones, y son la base de la espectroscopia.

Los iones cargados negativamente, producidos por haber más electrones que protones, se conocen como aniones (que son atraídos por el ánodo) y los cargados positivamente, consecuencia de una pérdida de electrones, se conocen como cationes (los que son atraídos por el cátodo).
Modelo atómico de Dálton

Surgido en el contexto de la química, fue el primer modelo atómico con bases científicas, formulado entre 1803 y 1807 por John Dalton.
EL NUMERO ATÓMICOEs el número entero positivo que equivale al número total de protónes en un núcleo del átomo. Se suele representar con la letra Z.
LA MASA ATÓMICAEs la cantidad de materia que tiene un átomo y generalmente se obtiene de sumar Z + N = AZ= el número de protónesN= el número de neutrónes
A= masa atómica
Enlaces químicos
Cuando los átomos se enlazan entre sí, ceden, aceptan o comparten electrones. Son los electrones de valencia quienes determinan de qué forma se unirá un átomo con otro y las características del enlace.
Regla del octeto.EL último grupo de la tabla periódica VIII A (18), que forma la familia de los gases nobles, son los elementos mas estables de la tabla periódica. Esto se deben a que tienen 8 electrones en su capa mas externa, excepto el Helio que tiene solo 2 electrones, que también se considera como una configuración estable.
Enlace iónico.
Está formado por metal + no metal
No forma moléculas verdaderas, existe como un agregado de aniones (iones negativos) y cationes (iones positivos).
Los metales ceden electrones formando por cationes, los no metales aceptan electrones formando aniones.
Los compuestos formados pos enlaces iónicos tienen las siguientes características:

Enlace covalente
Esta basado en la compartición de electrones. Los átomos no ganan ni pierden electrones, COMPARTEN.Esta formado por elementos no metálicos. Pueden ser 2 o 3 no metales.Pueden estar unidos por enlaces sencillos, dobles o triples, dependiendo de los elementos que se unen.o, tetracloruro de carbono, etc., e insolubles en solventes polares como el agua.
Los enlaces covalentes se clasifican en:
Para explicar las propiedades características de los metales (su alta conductividad eléctrica y térmica, ductilidad y maleabilidad, ...) se ha elaborado un modelo de enlace metálico conocido como modelo de la nube o del mar de electrones:
Los átomos de los metales tienen pocos electrones en su última capa, por lo general 1, 2 ó 3. Éstos átomos pierden fácilmente esos electrones (electrones de valencia) y se convierten en iones positivos

En 1808, Dalton publicó sus ideas sobre el modelo atómico de la materia las cuales han servido de base a la química moderna. Los principios fundamentales de esta teoría son:
- 1. La materia está formada por minúsculas partículas indivisibles llamadas átomos.
- 2. Hay distintas clases de átomos que se distinguen por su masa y sus propiedades. Todos los átomos de un elemento poseen las mismas propiedades químicas. Los átomos de elementos distintos tienen propiedades diferentes.
- 3. Los compuestos se forman al combinarse los átomos de dos o más elementos en proporciones fijas y sencillas. De modo que en un compuesto los de átomos de cada tipo están en una relación de números enteros o fracciones sencillas.
- 4. En las reacciones químicas, los átomos se intercambian de una a otra sustancia, pero ningún átomo de un elemento desaparece ni se transforma en un átomo de otro elemento..
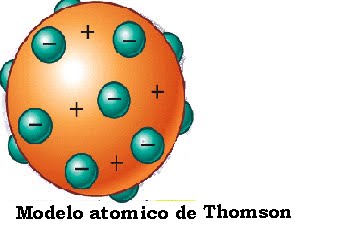
Modelo atómico de Joseph John Thomson

Joseph John "J.J." Thomson, (Mánchester, Inglaterra, 18 de diciembre de 1856 - Cambridge, Inglaterra, 30 de agosto de 1940) fue un científico británico, descubridor del electrón, de los isótopos e inventor del espectrómetro de masa. En 1906 fue galardonado con el Premio Nobel de Física.
La identificación por J.J. Thomson de unas partículas subatómicas cargadas negativamente, los electrones, a través del estudio de los rayos catódicos, y su posterior caracterización, le llevaron a proponer un modelo de átomo que explicara dichos resultados experimentales. Se trata del modelo conocido informalmente como el pudín de ciruelas, según el cual los electrones eran como 'ciruelas' negativas incrustadas en un 'pudín' de materia positiva.
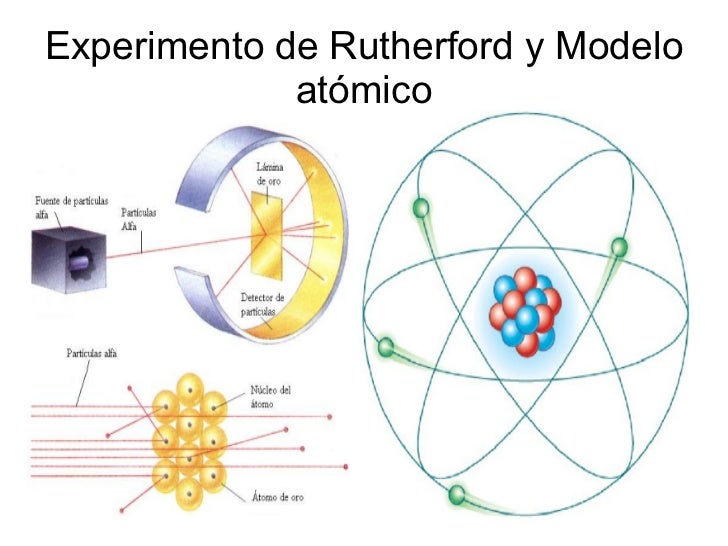
Modelo atómico de Ernest Rutherford

Es un modelo atómico o teoría sobre la estructura interna del átomo propuesto por el químico y físico británico-neozelandés Ernest Rutherford basándose en los resultados obtenidos en sus experimentos de bombardeo de láminas delgadas de metales, estableció el llamado modelo atómico de Rutherford o modelo atómico nuclear.
El átomo está formado por dos partes: núcleo y corteza.
El núcleo es la parte central, de tamaño muy pequeño, donde se encuentra toda la carga positiva y, prácticamente, toda la masa del átomo. Esta carga positiva del núcleo, en la experiencia de la lámina de oro, es la responsable de la desviación de las partículas alfa (también con carga positiva).
La corteza es casi un espacio vacío, inmenso en relación con las dimensiones del núcleo. Eso explica que la mayor parte de las partículas alfa atraviesan la lámina de oro sin desviarse.
Números cuánticos
Los números cuánticos son parámetros que describen el estado energético de un electrón y las características de un orbital.
Los 3 primeros números cuánticos (principal, secundario, magnético) son obtenidos como consecuencia de la resolución matemática de la ecuación de onda de Schrödinger, mientras que el cuarto número cuántico (spin magnético) lo introdujo Paul Dirac en 1928, reformulando la ecuación de onda.
La configuración electrónica (o C.E) indica la posición de cada electrón dentro de la envoltura nuclear, indicando en el nivel energético en el que éste se encuentra y en que orbital. Cada electrón puede ser identificado específicamente gracias a sus cuatro números cuánticos.Niveles energéticos de los orbitales atómicos según un diagrama de Moeller. La cola de la flecha indica cual se llena primero, mientras que la punta indica cual se llena al último. Se empieza desde abajo hacia arriba.
NÚMERO ATÓMICO Y MASA DE LOS ELEMENTOS
LA MASA ATÓMICAEs la cantidad de materia que tiene un átomo y generalmente se obtiene de sumar Z + N = AZ= el número de protónesN= el número de neutrónes
A= masa atómica
Enlaces químicos
Cuando los átomos se enlazan entre sí, ceden, aceptan o comparten electrones. Son los electrones de valencia quienes determinan de qué forma se unirá un átomo con otro y las características del enlace.
Regla del octeto.EL último grupo de la tabla periódica VIII A (18), que forma la familia de los gases nobles, son los elementos mas estables de la tabla periódica. Esto se deben a que tienen 8 electrones en su capa mas externa, excepto el Helio que tiene solo 2 electrones, que también se considera como una configuración estable.
Enlace iónico.
Está formado por metal + no metal
No forma moléculas verdaderas, existe como un agregado de aniones (iones negativos) y cationes (iones positivos).
Los metales ceden electrones formando por cationes, los no metales aceptan electrones formando aniones.
Los compuestos formados pos enlaces iónicos tienen las siguientes características:

Enlace covalente
Esta basado en la compartición de electrones. Los átomos no ganan ni pierden electrones, COMPARTEN.Esta formado por elementos no metálicos. Pueden ser 2 o 3 no metales.Pueden estar unidos por enlaces sencillos, dobles o triples, dependiendo de los elementos que se unen.o, tetracloruro de carbono, etc., e insolubles en solventes polares como el agua.
Los enlaces covalentes se clasifican en:
COVALENTES POLARES: los electrones se comparten de manera desigual, lo cual da por resultado que un extremo de la molécula sea parcialmente positivo y el otro parcialmente negativo.
COVALENTES NO POLARES: Cuando se enlazan dos átomos iguales, con la misma electronegatividad, la diferencia es cero, y el enlace es covalente no polar, ya que los electrones son atraídos por igual por ambos átomos.
COVALENTES COORDINADO: Se forma cuando el par electrónico compartido es puesto por el mismo átomo.
COVALENTES NO POLARES: Cuando se enlazan dos átomos iguales, con la misma electronegatividad, la diferencia es cero, y el enlace es covalente no polar, ya que los electrones son atraídos por igual por ambos átomos.
COVALENTES COORDINADO: Se forma cuando el par electrónico compartido es puesto por el mismo átomo.
Enlace metálico
Los átomos de los metales tienen pocos electrones en su última capa, por lo general 1, 2 ó 3. Éstos átomos pierden fácilmente esos electrones (electrones de valencia) y se convierten en iones positivos

sábado, 9 de mayo de 2015
Tabla periodica
Tabla periódica
Se conoce como tabla periódica de los elementos, sistema periódico o simplemente como tabla periódica, a un esquema diseñado para organizar y segmentar cada elemento químico, de acuerdo a las propiedades y particularidades que posea.Tabla periódicaEs una herramienta fundamental para el estudio de la química pues permite conocer las semejanzas entre diferentes elementos y comprender qué puede resultar de las diferentes uniones entre los mismos.
Estructura y organización de la tabla periódica
La tabla periódica actual es un sistema donde se clasifican los elementos conocidos hasta la fecha. Se colocan de izquierda a derecha y de arriba a abajo en orden creciente de sus números atómicos. Los elementos están ordenados en siete hileras horizontales llamadas periodos, y en 18 columnas verticales llamadas grupos o familias.Estructura y organización de la tabla periódica
Hacia abajo y a la izquierda aumenta el radio atómico y el radio iónico.
Hacia arriba y a la derecha aumenta la energía de ionización, la afinidad electrónica y la electronegatividad.
No MetalesLos no metales son los elementos situados por encima de la línea quebrada de los grupos 13 a 17 de la Tabla Periódica y el hidrógeno. Tienen muchos electrones en su capa externa; tiene elevado potencial de ionización, elevada afinidad electrónica, son electronegativos, son oxidantes, forman aniones y los óxidos e hidróxidos son ácidos. Tienen en común ser malos conductores de la electricidad y del calor. Suelen presentar enlace covalente. Los números de oxidación suelen ser negativos: ±4, -3, -2, -1; para el hidrógeno ±1.Muchos no metales se encuentran en todos los seres vivos: carbono, hidrógeno, oxígeno, nitrógeno, fósforo y azufre en cantidades importantes. Otros son oligoelementos: flúor, silicio, arsénico, yodo, cloro,...
Grupo 1: HidrógenoGrupo 13: BoroGrupo 14: CarbonoGrupo 15: Nitrógeno, fósforoGrupo 16: Oxígeno, azufre, selenio.Grupo 17: Flúor, cloro, bromo, yodo, astato.
Grupo 1: HidrógenoGrupo 13: BoroGrupo 14: CarbonoGrupo 15: Nitrógeno, fósforoGrupo 16: Oxígeno, azufre, selenio.Grupo 17: Flúor, cloro, bromo, yodo, astato.
MetaloidesEl término metaloide significa "parecido a un metal" y sirve para agrupar elementos que tienen algunas propiedades de metales y no metales. Los metaloides son elementos que se encuentran en la línea que separa metales y no metales. Esta línea pasa entre el boro y aluminio y acaba entre el polonio y el astato. El aluminio se considera otro metal. El resto de los elementos vecinos a esta línea tienen características intermedias metal-no metal. Los más claros son los cinco que se mencionan a continuación y que se emplean en la fabricación de dispositivos de estado sólido en ordenadores y calculadoras (son semiconductores: pueden conducir la corriente en determinadas condiciones).
Grupo 13: Boro.Grupo 14: Silicio, germanio.Grupo 15: Arsénico, antimonio.Grupo 16: Teluro.
MetalesCorresponde a los elementos situados a la izquierda y centro de la Tabla Periódica (Grupos 1 (excepto hidrógeno) al 12, y en los siguientes se sigue una línea quebrada que, aproximadamente, pasa por encima de Aluminio (Grupo 13), Germanio (Grupo 14), Antimonio (Grupo 15) y Polonio (Grupo 16) de forma que al descender aumenta en estos grupos el carácter metálico). Un elemento es metal cuando tiene tendencia a desprenderse de los electrones de su última capa o capa de valencia (formando cationes); tienen pocos electrones en la última capa, bajo potencial de ionización, baja afinidad electrónica, baja electronegatividad, son reductores, forman cationes, los óxidos e hidróxidos son básicos o anfóteros (para un mismo estado de oxidación según se desciende en un grupo aumenta el carácter metálico: aumenta la basicidad de los óxidos); aunque según se desciende en cada grupo, los números de oxidación altos producen óxidos cada vez más ácidos. Son sólidos, salvo excepciones. Se caracterizan por poseer enlace metálico. Por todo ello son buenos conductores del calor, electricidad, son dúctiles, maleables, etc.,.Se utilizan con fines estructurales, fabricación de recipientes, conducción del calor y la electricidad.Muchos de los iones metálicos cumplen funciones biológicas importantes: hierro, calcio, magnesio, sodio, potasio, cobre, manganeso, cinc, cobalto, molibdeno, cromo, estaño, vanadio, níquel,..
Lantánidos:
Lantano, cerio, praseodimio, neodimio, prometio, samario, europio, gadolinio, terbio, disprosio, holmio, erbio, tulio, iterbio, lutecio.
Son elementos cuya proporción en la corteza terrestre es del orden del 0,02% en peso (el prometio es artificial). Debido a que la mayoría de las propiedades son parecidas y se encuentran en los mismos minerales son difíciles de separar.
Son elementos del periodo 6 que llenan orbitales 4f teniendo las capas 5 y 6 incompletas. Como se trata de una capa interna las diferencias de unos a otros son mínimas: su separación sólo se ha logrado con el desarrollo de las técnicas de intercambio iónico, utilizando la propiedad que tienen de formar complejos aniónicos. Los metales se obtienen metalotérmicamente con sodio, calcio, magnesio o lantano en atmósfera inerte a partir de los eluidos o de otros compuestos. La electrólisis de una mezcla fundida de cloruros de lantánidos anhídros conduce a la aleación mischmetal.
Son metales de brillo argentífero que se oxidan rápidamente al aire y son bastante reactivos. El estado de oxidación que adoptan todos en sus combinaciones es +3; además, en el caso de samario, europio, tulio e iterbio pueden adoptar +2, y en el caso de cerio, praseodimio, neodimio, terbio y disprosio +4. Se disuelven en agua y en ácidos con desprendimiento de hidrógeno; reaccionan fácilmente con hidrógeno, (formando fases sólidas negras en las que por cada átomo de lantánido hay 2-3 de hidrógeno), cloro (formando el tricloruro), oxígeno (formando el trióxido) y nitrógeno (formando mononitruro con estructura cristalina tipo cloruro de sodio). La basicidad de los hidróxidos disminuye al aumentar el número atómico.
Se utilizan como catalizadores en el craqueo del petróleo, como material luminoso en los televisores en color, lámparas de mercurio, etc.
Actínidos:Actinio, torio, protactinio, uranio, neptunio, plutonio, americio, curio, berkelio, californio, einsteinio, fermio, mendelevio, nobelio, lawrencio.Hasta 1940 sólo se conocían torio, protactinio y uranio que se situaban en los grupos 4, 5 y 6 del Sistema Periódico. Al sintetizarse en 1944 el neptunio y el plutonio se comprendió que eran miembros de un grupo análogo al de los lantánidos.
Son elementos del periodo 7 que llenan orbitales 5f teniendo las capas 6 y 7 incompletas, por lo que sus propiedades químicas son muy parecidas entre sí y a las de los lantánidos, salvo que presentan mayor número de estados de oxidación, pues los electrones 5f están más alejados del núcleo.
Son metales blanco plateados, reactivos que se oxidan rápidamente en contacto con el aire. Reaccionan con el agua y los ácidos desprendiendo hidrógeno. También lo hacen fácilmente con el hidrógeno, cloro, oxígeno y nitrógeno presentado diferentes estados de oxidación, aunque +3 es común a todos ellos. La basicidad de los trihidróxidos disminuye al aumentar el número atómico.Todos son radiactivos, aunque los primeros miembros del grupo tienen períodos de semidesintegración bastante grandes.
Son metales blanco plateados, reactivos que se oxidan rápidamente en contacto con el aire. Reaccionan con el agua y los ácidos desprendiendo hidrógeno. También lo hacen fácilmente con el hidrógeno, cloro, oxígeno y nitrógeno presentado diferentes estados de oxidación, aunque +3 es común a todos ellos. La basicidad de los trihidróxidos disminuye al aumentar el número atómico.Todos son radiactivos, aunque los primeros miembros del grupo tienen períodos de semidesintegración bastante grandes.
Gases NoblesLos gases nobles se encuentra en el grupo 0 o 18 de la Tabla Periódica. Los elementos son: helio, neón, argón, criptón, xenón, radón y ununoctio. Estos elemento se consideraron inertes hasta 1962, debido a que su estado de oxidación es 0, teniendo 8 electrones en su última capa (2 electrones s y 6 electrones p), lo que les impide formar compuestos fácilmente. Tienen una energía de ionización muy alta, por lo que son muy estables. Debido a esto, fueron descubiertos muy tarde: Cavendish en 1785 aisló el primero, a partir del aire, aunque no fue capaz de identificarlo. En 1868 Jannsen descubre el helio y, a partir de 1894, Ramsay, Travers y Rayleigh aíslan e identifican los gases nobles, excepto radón, que fue descubierto por Dorn en 1898 y aislado por Ramsay y Gray en 1908.
El helio es el segundo elemento más abundante del Universo. En la atmósfera hay un 1% de gases nobles (fundamentalmente argón (0,94%)).
Su uso principal está en iluminación: tubos de descarga (helio da color marfil, neón rojo, argón azul rojizo, criptón azul verdoso y xenón violeta); bombillas incandescentes (criptón y xenón, que impiden la difusión térmica del metal del filamento y aumentan la temperatura de trabajo y el rendimiento luminoso). Otros usos son la creación de atmósferas inertes en soldadura y corte (argón), relleno de globos (helio), gases de inmersión (helio), refrigerantes para bajas temperaturas y superconductividad (helio, neón).
Su uso principal está en iluminación: tubos de descarga (helio da color marfil, neón rojo, argón azul rojizo, criptón azul verdoso y xenón violeta); bombillas incandescentes (criptón y xenón, que impiden la difusión térmica del metal del filamento y aumentan la temperatura de trabajo y el rendimiento luminoso). Otros usos son la creación de atmósferas inertes en soldadura y corte (argón), relleno de globos (helio), gases de inmersión (helio), refrigerantes para bajas temperaturas y superconductividad (helio, neón).
Grupos
A las columnas verticales de la tabla periódica se les conoce como grupos o familias. Hay 18 grupos en la tabla periódica estándar, de los cuales diez son grupos cortos y los ocho restantes largos, que muchos de estos grupos correspondan a conocidas familias de elementos químicos: la tabla periódica se ideó para ordenar estas familias de una forma coherente y fácil de ver.
Por ejemplo, los elementos en el grupo 1 tienen una configuración electrónica ns1 y una valencia de 1 (un electrón externo) y todos tienden a perder ese electrón al enlazarse como iones positivos de +1. Los elementos en el último grupo de la derecha son los gases nobles, los cuales tienen lleno su último nivel de energía (regla del octeto) y, por ello, son excepcionalmente no reactivos y son también llamados gases inertes.
Numerados de izquierda a derecha utilizando números arábigos, según la última recomendación de la IUPAC (según la antigua propuesta de la IUPAC) de 1988 y entre paréntesis según el sistema estadounidense, los grupos de la tabla periódica son:
Por ejemplo, los elementos en el grupo 1 tienen una configuración electrónica ns1 y una valencia de 1 (un electrón externo) y todos tienden a perder ese electrón al enlazarse como iones positivos de +1. Los elementos en el último grupo de la derecha son los gases nobles, los cuales tienen lleno su último nivel de energía (regla del octeto) y, por ello, son excepcionalmente no reactivos y son también llamados gases inertes.
Numerados de izquierda a derecha utilizando números arábigos, según la última recomendación de la IUPAC (según la antigua propuesta de la IUPAC) de 1988 y entre paréntesis según el sistema estadounidense, los grupos de la tabla periódica son:
Grupo 1 (I A): los metales alcalinos
Grupo 2 (II A): los metales alcalinotérreos.
Grupo 3 (III B): familia del Escandio (tierras raras y actínidos).
Grupo 4 (IV B): familia del Titanio.
Grupo 5 (V B): familia del Vanadio.
Grupo 6 (VI B): familia del Cromo.
Grupo 7 (VII B): familia del Manganeso.
Grupo 8 (VIII B): familia del Hierro.
Grupo 9 (VIII B): familia del Cobalto.
Grupo 10 (VIII B): familia del Níquel.
Grupo 11 (I B): familia del Cobre.
Grupo 12 (II B): familia del Zinc.
Grupo 13 (III A): los térreos.
Grupo 14 (IV A): los carbonoides.
Grupo 15 (V A): los nitrogenoides .
Grupo 16 (VI A): los calcógenos o anfígenos.
Grupo 17 (VII A): los halógenos.
Grupo 18 (VIII A): los gases nobles.
Grupo 2 (II A): los metales alcalinotérreos.
Grupo 3 (III B): familia del Escandio (tierras raras y actínidos).
Grupo 4 (IV B): familia del Titanio.
Grupo 5 (V B): familia del Vanadio.
Grupo 6 (VI B): familia del Cromo.
Grupo 7 (VII B): familia del Manganeso.
Grupo 8 (VIII B): familia del Hierro.
Grupo 9 (VIII B): familia del Cobalto.
Grupo 10 (VIII B): familia del Níquel.
Grupo 11 (I B): familia del Cobre.
Grupo 12 (II B): familia del Zinc.
Grupo 13 (III A): los térreos.
Grupo 14 (IV A): los carbonoides.
Grupo 15 (V A): los nitrogenoides .
Grupo 16 (VI A): los calcógenos o anfígenos.
Grupo 17 (VII A): los halógenos.
Grupo 18 (VIII A): los gases nobles.
Periodos
Las filas horizontales de la tabla periódica son llamadas períodos. El número de niveles energéticos de un átomo determina el periodo al que pertenece. Cada nivel está dividido en distintos subniveles.
La tabla periódica consta de 7 períodos:
Las filas horizontales de la tabla periódica son llamadas períodos. El número de niveles energéticos de un átomo determina el periodo al que pertenece. Cada nivel está dividido en distintos subniveles.
La tabla periódica consta de 7 períodos:
BloquesLa tabla periódica se puede también dividir en bloques de elementos según el orbital que estén ocupando los electrones más externos, de acuerdo al principio de Aufbau.
Los bloques o regiones se denominan según la letra que hace referencia al orbital más externo: s, p, d y f. Podría haber más elementos que llenarían otros orbitales, pero no se han sintetizado o descubierto; en este caso se continúa con el orden alfabético para nombrarlos.
Bloque s, Bloque p, Bloque d, Bloque f y Bloque g (bloque hipotético)
Los bloques o regiones se denominan según la letra que hace referencia al orbital más externo: s, p, d y f. Podría haber más elementos que llenarían otros orbitales, pero no se han sintetizado o descubierto; en este caso se continúa con el orden alfabético para nombrarlos.
Bloque s, Bloque p, Bloque d, Bloque f y Bloque g (bloque hipotético)
Suscribirse a:
Comentarios (Atom)









